作者:陈康 教授 中国人民解放军总医院第一医学中心
近期一则新闻引起广泛的关注,即上海长征医院联合中科院利用自体再生胰岛移植导致1例糖尿病患者从
➤首先,该领域的技术门槛和成本门槛决定着该项技术未来应用推广的难度之一;
➤第二,此例病例的一个突出特征是进行的肾脏移植(因
➤第三,从专业的角度讲,干细胞衍生的胰岛是当前胰岛病理生理和分子生物学的集大成者,是两各截然不同的极具吸引力的糖尿病终极研究领域之一(另一个是闭环胰岛素泵和人工胰),进展非常迅速;但当前推广到临床最大的障碍是更高效、更长效、更安全和性价比的问题。
新技术评论系列 l 2024
干细胞来源的胰岛疗法新开始......
干细胞来源的胰岛在临床上的应用近期频繁引起热议,这项技术目前主要用于控制1型糖尿病患者的血糖;新技术的初期应用总是用在最需要该技术的人群。该领域正在进行的研究可以预期对糖尿病的现代治疗具有变革性。
100多年前胰岛素的发现为 1 型糖尿病 (T1DM) 患者提供了一种革命性的、维持生命的治疗方法,这些患者由于失去内源性产生胰岛素的胰岛而无法自我调节血液中的
而设备技术取得了巨大进步,最终形成了下一代闭环系统,该系统包含灵敏的
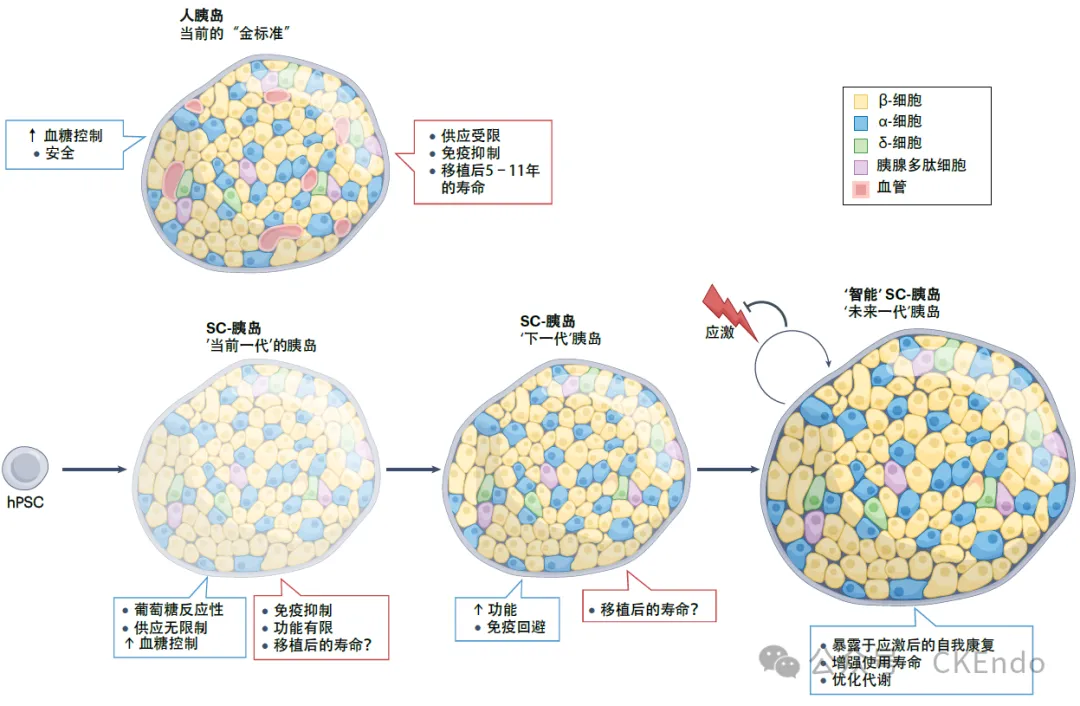
图1:从人胰岛到“智能”SC胰岛
注:当前在从产生和分泌胰岛素的人多能干细胞(hPSC)产生干细胞胰岛(SC-胰岛)方面取得了显著进展。预计“下一代”SC胰岛将更接近人类胰岛“金标准”,同时具有额外获益,例如自带逃避宿主免疫系统破坏的能力。进一步的技术和生物学进步将产生“下一代”的“智能”SC胰岛,这些胰岛具有增强的弹性和寿命。蓝色轮廓,优点;红色轮廓,缺点。
多年来将人类胰岛发育转化为体外干细胞分化方案,成功产生了与其主要对应物相似的干细胞来源胰岛(SC-胰岛)。因此,SC-胰岛在葡萄糖刺激下分泌胰岛素,并在移植到糖尿病动物模型中时改善血糖控制。这项工作迎来了开创性的临床试验,其中 SC 胰岛被移植到 T1DM 患者(NCT04786262)患者体内。据报道,在移植SC(干细胞衍生)-胰岛后,所有患者的血糖控制都得到了改善,并且需要降低外源性胰岛素水平或可完全独立于胰岛素(不依赖胰岛素)。尽管如此,目前的SC(干细胞衍生)胰岛还不能完全等同于内源性胰岛。由于预计 SC 胰岛的临床存在不断增加,正在对方案进行微调,以解决 SC 胰岛与人类胰岛之间仍然存在的差异;例如,代谢、转录组、染色质结构和脱靶细胞群等方面的差异。通过进一步改进分化方案来提高SC胰岛质量,并且用于SC胰岛移植的细胞将比当前的更少。因此,当有更多的SC胰岛资源,将可能克服该技术的第一个障碍——胰岛移植可及性(即当前胰岛难以获得)。
下一个需要解决的直接障碍是防止免疫排斥。
移植后,如果不加以保护,SC胰岛会受到宿主免疫系统的攻击和破坏。免疫抑制药物用于预防移植物排斥反应,但对于大多数糖尿病患者来说,与全身免疫抑制剂相关的各种负面不良反应超过了胰岛移植的获益。代替免疫抑制剂,可以通过胰岛封装、免疫隐身、产生局部免疫保护生态位或使用干细胞库进行组织匹配来规避免疫排斥反应。封装胰岛的装置旨在实现胰岛和宿主之间的营养、氧气和激素交换,同时物理阻止胰岛的免疫破坏。尽管生物相容性一直是该领域的主要挑战,但这些设备或技术的改进迭代正在积极进入临床试验 (NCT05791201)。或者,与其在胰岛和宿主之间建立屏障,不如对胰岛进行基因改造以逃避宿主免疫系统。这一目标是通过操纵胰岛细胞上表达的抗原来实现的,这样它们就不会触发免疫反应。将这一策略更进一步,SC胰岛也可以被修饰以分泌诱导局部免疫抑制作用的特定细胞因子,从而有效地创造一个受保护的有限生态位。此外,SC胰岛免疫保护生态位可以通过免疫调节细胞类型的共同移植形成,例如旨在识别SC胰岛并抑制宿主免疫细胞攻击的调节性T细胞或抑制细胞。需要特别注意的是,如果细胞感染病毒或发生恶性转化,SC胰岛免疫细胞靶向的丧失可能是有风险的。
另一种方法是从与大部分人群免疫相容的“超级供体”中产生诱导多能干细胞(iPSC)库。然后可以从这些iPSC中产生 SC 胰岛以匹配个体患者。由于这种方法的复杂性,它可能只适用于具有高度遗传相似性的人群。此外,这种策略不太可能是自身免疫性糖尿病的可行选择。总体而言,为克服免疫排斥而进行的创新研究有望在未来数年内产生一些巧妙的免疫抑制剂替代品。
目前一个关键的未确定变量是移植后 SC 胰岛将能保持活力和功能多长时间。将尸体人胰岛移植到 T1DM 患者体内的数据表明,移植后 5 年,50%-70%的受者仍可保持对胰岛素非依赖性。超过这个时间点,患者可能会继续经历胰岛的有益效果,但部分最终将需要恢复外源性胰岛素注射。SC胰岛的表现是否相似,还是弱于以往的胰岛,很快就会揭晓。无论如何,增强SC胰岛的功能和寿命是特别令人感兴趣的。
胰岛已经进化到具有产生和分泌胰岛素的强大能力。然而,在移植过程中和整个体内时间,胰岛暴露于各种可能损害功能的应激/破坏源。因此,干细胞治疗的一个关键问题是,是否可以利用技术进步和对胰岛生物学的了解来生产比目前的SC胰岛更具生存韧性的SC胰岛,且具有更大的功能。已经收集大量关于胰岛细胞的细胞内和细胞间网络的数据;但是,集成此信息以优化胰岛功能可能需要实施人工智能相关的方法。例如,葡萄糖代谢对胰岛素分泌至关重要,因此在该领域进行了广泛的研究,但每种代谢途径和代谢物对胰岛素分泌的重要性和相互联系仍不清楚。通过将机器学习应用于这一领域,研究人员可能能够将每个酶促反应的相关贡献分配给葡萄糖刺激的胰岛素分泌。然后,这些酶的结构模型可用于预测遗传操作如何增加或减少酶活性。然后,这些知识可以应用于SC胰岛,以改变代谢通量并提高代谢效率,从而维持胰岛素分泌能力。
类似的策略也可用于生产SC胰岛,这些胰岛对移植时遇到的各种应激更具弹性/韧性。胰岛细胞已经开发出复杂的天然传感器来调节和抵消应激反应,但如果应激程度过大或细胞失去触发适应性反应的先天能力,应激会导致功能丧失。理想情况下,细胞可以通过引发逆反应来响应这些传感器蛋白活性或丰度的高阈值,可能是通过开发遗传反馈回路。目标是设计和生成能够启动应激诱发临时对策的SC胰岛,从而允许生存和延长寿命:即所谓的自我修复或“智能”SC胰岛(图1)。
本文小结
总之,干细胞生物学和胰岛移植的显著进展为SC胰岛奠定基础,从而可能引发了对糖尿病患者照护的巨大变化。SC胰岛的引入标志着一个新时代的开始。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)